糖基化是普遍存在的翻译后修饰,蛋白质的糖基化模式决定了其结构、功能以及细胞识别和信号传导等过程,与细胞生理状态的动态响应、疾病的进程和状态密切相关。因此,对活细胞表面特定蛋白糖型的原位检测有助于加深对糖基化机制和蛋白功能的理解,也可为疾病特别是癌症的诊断和治疗提供靶标。
我院鞠熀先教授课题组自2007年以来,积极开展这一挑战性课题的研究,先后在国家自然科学基金重大研究计划、重点项目和973项目资助下,通过设计两表面一分子竞争识别策略和聚糖电化学检测芯片,提出细胞表面糖基原位检测的系列方法(J. Am. Chem. Soc. 2008, 130, 7224; Angew. Chem. Int. Ed. 2009, 48, 6465等),曾获2013年教育部自然科学一等奖。同时,通过组装P-糖蛋白抗体功能化仿生界面,提出电极界面上细胞检测新方法;并引入“化学选择性聚糖识别”,提出细胞表面多种聚糖的同时定量和聚糖密度的分析策略,是2016年江苏省科学技术一等奖的主要内容。2015年以来,该研究组在细胞表面特定蛋白糖型的成像方法学研究方面取得重要进展,发展了特定蛋白质上的糖基与多种糖型的原位检测方法(Chem. Sci. 2015, 6, 3769; Chem. Sci. 2016, 7, 569; Anal. Chem. 2016, 88, 2923; Angew. Chem. Int. Ed. 2016, 55, 5220)。近期,他们用核酸适配体(Apt)标记半乳糖氧化酶(GO),利用Apt识别细胞表面特定蛋白质和GO的活性“开关”,构建了一种局域聚糖化学重构策略,实现了活细胞表面特定蛋白的糖型成像,于2017年5月29日在线发表(Angew. Chem. Int. Ed. DOI: 10.1002/anie.201703406)。
该局域聚糖化学重构策略由14级硕士研究生惠晶晶为第一作者、丁霖副教授和鞠熀先教授为通讯作者提出。他们以MUC1黏蛋白为研究模型,首先利用Apt与MUC1的特异性识别将亚铁***抑制的GO定位至MUC1上。然后用铁***激活GO,催化氧化细胞表面MUC1的末端半乳糖/N-乙酰半乳糖胺(Gal/GalNAc)生成醛基,通过醛基-生物素酰肼的快速反应将FITC标记在目标Gal/GalNAc上,用化学反应活性作为信号报告系统,实现了活细胞表面特定蛋白糖型的原位检测(图1,2)。与通常糖代谢标记技术相比,局域聚糖化学重构策略仅对目标蛋白上聚糖进行标记,标记过程与细胞自身功能无关,避免了“代谢效率”的异质性问题,为不同细胞系特定蛋白上糖型表达的研究提供了重要工具和方法模型。这是该课题组在细胞功能分子检测方法学研究领域的又一项重要进展。
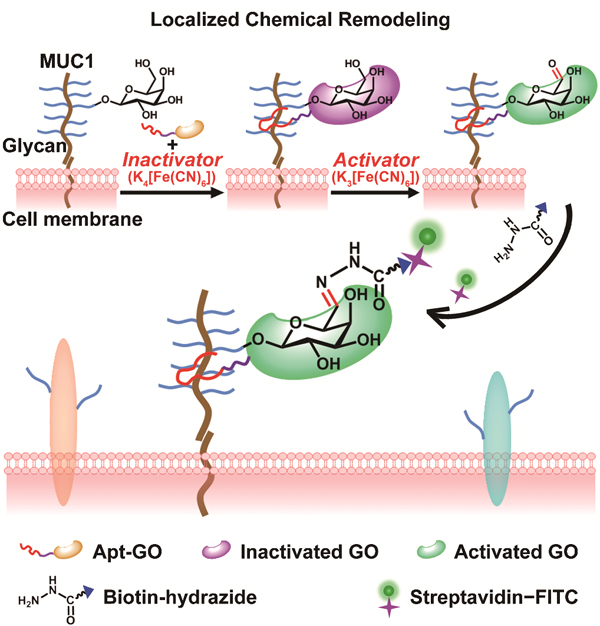 图1. 局域聚糖化学重构策略的原理示意图
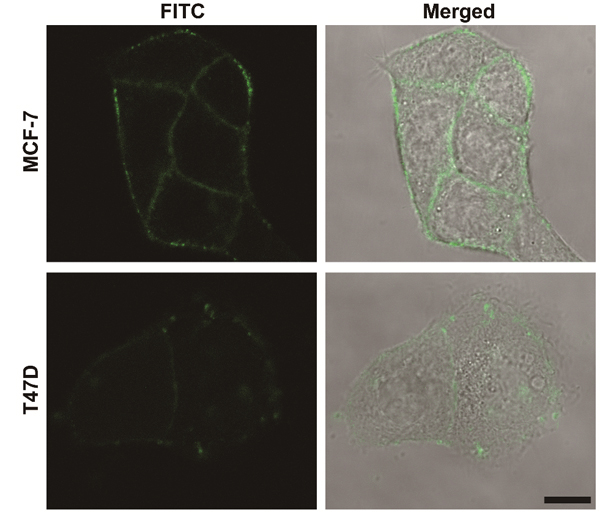 图2. 利用局域聚糖化学重构策略对MCF-7和T47D细胞上MUC1的
末端半乳糖/N-乙酰半乳糖胺进行成像
|
